溶液配制的基本步骤及其注意事项
上海化学检验员证书考试内容、南京化学检验员培训报名绿色通道、杭州化学检验工培训考证费用、南京化学检验工证书报名资料、上海化学检验员证书难不难考、杭州化学检验员培训报考资格、南京化学检验工培训考试条件、上海化学检验工证书含金量
溶液配制的基本步骤及其注意事项
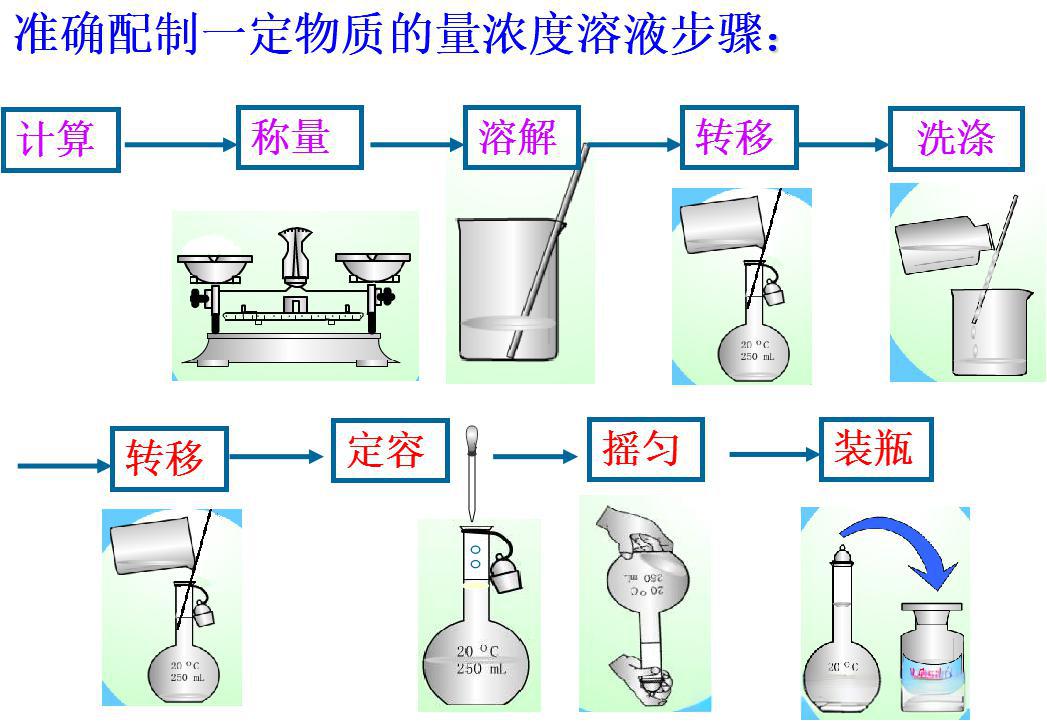
溶液的配制是化学实验中一项基础而关键的操作,其准确性直接影响实验结果。以下是溶液配制的 基本步骤 及 关键注意事项,按流程顺序梳理如下:
一、溶液配制的基本步骤
计算所需溶质质量
根据公式 m=c×V×M(质量=浓度×体积×摩尔质量)计算溶质质量。
注意:若溶质为结晶水合物(如Na₂CO₃·10H₂O),需扣除结晶水质量。
准备仪器与试剂
选择合适的仪器:天平(精度匹配溶质质量)、烧杯、玻璃棒、容量瓶(规格与溶液体积一致)、量筒或移液管。
检查容量瓶是否漏水,清洗所有仪器并干燥(若溶质易潮解,如NaOH,需快速操作)。
称量或量取溶质
固体溶质:用天平称量(如NaOH需放在烧杯或表面皿中快速称量)。
液体溶质:用量筒或移液管量取(如浓硫酸需用干燥量筒)。
注意:避免用手直接接触称量瓶或烧杯内壁。
溶解或稀释溶质
在烧杯中加入少量溶剂(如水),搅拌溶解。
特殊操作:
浓硫酸稀释:需“酸入水,沿器壁,慢慢倒,不断搅”。
易挥发物质(如浓盐酸):在通风橱中操作。
转移溶液至容量瓶
待溶液冷却至室温后,用玻璃棒引流转移至容量瓶。
注意:烧杯口紧贴玻璃棒,避免液体溅出。
洗涤烧杯与玻璃棒
用少量溶剂洗涤烧杯2-3次,洗涤液一并转移至容量瓶。
定容
继续向容量瓶中加入溶剂至凹液面最低点与刻度线平视相切。
关键操作:定容时需平视刻度线,不可俯视或仰视。
摇匀溶液
塞紧瓶塞,倒置摇匀数次,使溶液浓度均匀。
注意:若配制悬浊液或乳浊液,需延长摇匀时间。
贴标签
标注溶液名称、浓度、配制日期及配制人。

二、关键注意事项
仪器选择
容量瓶需与溶液体积匹配(如配制500mL溶液需用500mL容量瓶)。
量取液体时:接近所需刻度时改用胶头滴管。
温度控制
溶解时若放热(如NaOH溶解),需冷却至室温再转移定容。
容量瓶的标称体积通常为20℃,若溶液温度偏离需校正体积。
纯度与误差
溶质纯度需已知(如使用基准试剂需扣除杂质质量)。
天平精度需匹配溶质质量(如配制0.1mol/L溶液需用0.1mg天平)。
安全操作
配制腐蚀性溶液(如浓硫酸)时需佩戴防护手套。
通风橱内操作有毒或挥发性物质(如HCl气体)。
三、特殊案例处理
易水解物质(如FeCl₃):需加少量稀盐酸抑制水解。
易氧化物质(如KMnO₄):需现配现用,避光保存。
分段稀释:配制极稀溶液时(如将浓溶液稀释1000倍),需先稀释10倍,再取此溶液稀释100倍,减少误差。
通过以上步骤和注意事项,可确保溶液配制的准确性。若需长期保存,需遵循标准溶液的储存要求(如避光、冷藏、密封)。
杭州化学检验工培训考证对象、南京化学检验工证书考试时间、上海化学检验员证书好考吗、南京化学检验员培训报名要求

随机推荐
相关内容
- 12-12常见几种不容物质测定实验方法介绍
- 11-07长沙材料力学性能检验员证书报考对象、考试难度以及证书含金量全解析
- 12-17什么是抽样检验?抽样检验的基本概念!
- 03-22广东省化妆品检验员资格认证报名时间
- 07-05原子吸收光谱法
- 11-20影响指示剂变色范围的因素

 »
» 