当前位置:主页 > 常见问题 >什么是滴定终点?操作要注意哪些?
什么是滴定终点?操作要注意哪些?
发表于:2025-12-17来源:www.chempx.com
化学检验员培训报名官网、化学检验工培训考试内容
什么是滴定终点?操作要注意哪些?

滴定终点是滴定分析中通过指示剂颜色变化或仪器信号突变,判断滴定剂与被测物质恰好完全反应的临界点,其准确性直接影响分析结果的可靠性。以下是详细解释及操作注意事项:
一、滴定终点的定义
滴定终点是指在滴定过程中,通过观察指示剂颜色变化、电位突变或其他物理信号,判断滴定剂与被测物质达到化学计量点(理论反应终点)的瞬间。此时,滴定剂加入量与被测物质完全反应所需的量相等,但实际中由于指示剂选择或反应条件限制,滴定终点可能与化学计量点存在微小偏差。化学检验员培训考试时间
二、操作注意事项1. 指示剂的选择与使用
匹配反应类型:根据滴定反应类型选择合适的指示剂。例如:
酸碱滴定:酚酞(pH 8.2-10.0,无色→红色)、甲基橙(pH 3.1-4.4,红色→黄色)。
氧化还原滴定:二苯胺磺酸钠(无色→紫色)、淀粉(碘量法中蓝色出现或消失)。
络合滴定:铬黑T(蓝色→酒红色)、钙指示剂(红色→蓝色)。
控制用量:指示剂用量过多可能导致终点颜色变化不敏锐,甚至引入干扰。例如,酚酞用量过多可能使终点颜色偏深,影响判断。化学检验工培训报考资料
避免干扰:某些指示剂可能与滴定剂或被测物质发生副反应,需通过空白实验或对照实验验证。
2. 滴定速度的控制
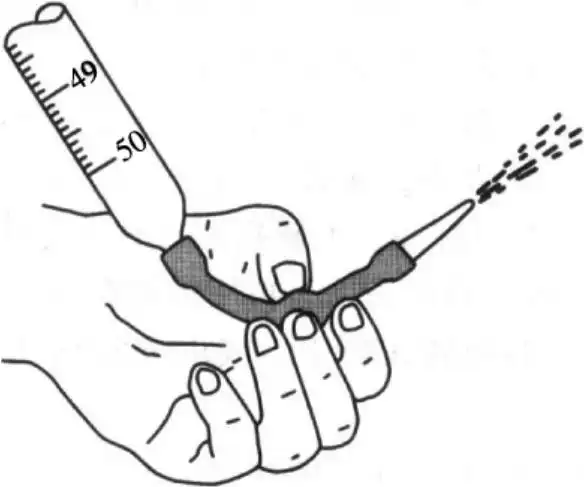
初始阶段:可较快滴加滴定剂(如每秒3-4滴),接近终点时减慢速度(如每滴间隔10-15秒)。
终点附近:逐滴加入,甚至用半滴或微滴操作(如用洗耳球吹洗滴定管尖端),避免过量导致误差。
避免“过滴”:过量滴定剂可能使终点颜色变化不可逆,或引发副反应(如氧化还原滴定中过量氧化剂继续氧化指示剂)。
3. 溶液均匀性
搅拌或摇动:滴定过程中需持续搅拌或摇动锥形瓶,使溶液混合均匀,避免局部浓度差异导致终点提前或滞后。化学检验员培训考试报名要求
避免溅出:剧烈摇动可能导致溶液溅出,需控制力度,尤其是对挥发性物质(如氨水)或易起泡溶液(如表面活性剂)。

反应敏感性:某些滴定反应对温度敏感(如络合滴定中EDTA与金属离子的反应),需在恒温条件下进行或记录温度以修正结果。
指示剂稳定性:高温可能使指示剂分解或变色范围改变(如酚酞在高温下可能失效)。
5. 滴定管与仪器校准
滴定管校准:使用前需检查滴定管是否漏液,并用标准溶液润洗以避免残留水稀释滴定剂。
读数精度:读取滴定管体积时,需保持视线与液面凹液面最低点平齐,避免视差误差。
仪器信号校准:使用电位滴定仪或自动滴定仪时,需定期校准电极或传感器,确保信号准确性。化学检验工培训考证机构
6. 空白实验与对照
空白实验:在不加被测物质的情况下进行滴定,扣除空白值以消除试剂或溶剂中的干扰成分。
对照实验:用已知浓度的标准溶液进行滴定,验证操作方法和指示剂的可靠性。
7. 环境因素
光线影响:某些指示剂(如甲基橙)在强光下可能褪色,需避免阳光直射或使用棕色试剂瓶。
气体干扰:酸碱滴定中,二氧化碳可能溶解于水形成碳酸,影响pH判断,需用新煮沸并冷却的蒸馏水配制溶液。
三、常见误差来源及避免方法化学检验员培训报名对象
指示剂误差:终点颜色判断过早或过晚。
避免方法:选择变色范围与化学计量点pH或电位匹配的指示剂,并通过预实验确定最佳用量。
滴定剂浓度误差:滴定剂实际浓度与标称值不符。
避免方法:定期标定滴定剂浓度,使用基准物质(如碳酸钠标定盐酸)。
操作习惯误差:如滴定管读数习惯性偏高或偏低。
避免方法:规范读数姿势,通过多次练习形成统一标准。
终点判断误差:对颜色变化不敏锐或犹豫导致过量。
避免方法:在白色背景下观察颜色变化,或使用电位滴定仪等自动判断终点。
化学检验员培训报考要求、化学检验工培训考试费用
随机推荐
- 06-14实验室纯水的分级标准
- 07-31实验室废弃物质前处理和日常处理方法
- 11-0111月化学检验员资格认证报名通知
- 01-08紧缺工种工业废水处理工资格证书在哪里报考
- 06-18长沙工业废水处理工证书考试考什么?报名需要什么条件?
- 09-20使用分光光度计都有什么注意事项?
相关内容
- 11-3012月水质检验员培训培训报名去哪里
- 03-24东莞哪里报高级化学检验员资格认证培训考证
- 07-23厦门污水处理工职业全解析:工作内容、考试形式与职业发展路径
- 05-26实验室火灾应急处理预案
- 08-16化学实验室常用加热方式
- 08-22广州怎么考化学检验工证书?报考有什么要求?

 »
» 